淋巴瘤动态
卢绪章教授:格菲妥单抗为R/R PCNSL患者带来临床突破,驱动中枢淋巴瘤治疗新时代
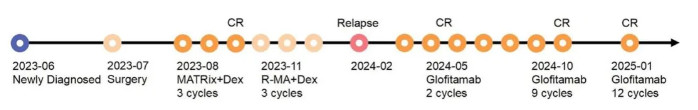
原发性中枢神经系统淋巴瘤(PCNSL)是一种罕见且侵袭性极强的非霍奇金淋巴瘤,发生于脑实质、脊髓、脑膜甚至眼部,是免疫特权部位的大B细胞淋巴瘤[1]。尤其是复发/难治性(R/R)PCNSL治疗缺乏标准、有效的方案,传统药物难以穿透血脑屏障,放疗放射性脑损伤风险大,患者生活质量和存活期均难以提升[2]。在该背景下,免疫治疗的新策略备受关注。格菲妥单抗(Glofitamab)作为CD20×CD3的双特异性抗体,已在系统性弥漫大B细胞淋巴瘤(DLBCL)领域展现优异疗效。其独特的2:1结构设计使其更强效地结合CD20阳性肿瘤细胞并招募T细胞杀伤肿瘤[3]。近日,格菲妥单抗新适应症已获得中国国家药品监督管理局的上市批准,联合吉西他滨与奥沙利铂(GemOx)用于治疗不适合自体造血干细胞移植(ASCT)的复发或难治性DLBCL非特指型(DLBCL NOS)成人患者(2L+ DLBCL)。 近期,南京医科大学第三附属医院(常州市第二人民医院)卢绪章教授团队报告了全球首例使用格菲妥单抗成功诱导复发PCNSL 患者达到快速、深度的完全缓解(CR),而且在治疗12 个周期后依然持续缓解[4]。这一成果不仅填补了该领域治疗空白,也为血脑屏障限制下的中枢肿瘤免疫治疗提供了宝贵的临床和基础数据。为深入解读该研究及格菲妥单抗在PCNSL治疗的未来潜力,【肿瘤资讯】专访了卢绪章教授,邀请其分享最新临床研究的核心亮点、机制解析及发展方向。 格菲妥单抗在复发PCNSL患者中实现快速深度缓解,突破传统治疗瓶颈 根据2022年WHO最新分类,PCNSL属于免疫特权区淋巴瘤,临床治疗困难且预后堪忧。患者即便初期接受高剂量甲氨蝶呤联合化疗、免疫治疗及放疗,仍有约25%-50%复发,且约15%-25%初始即为难治患者,导致整体生存率明显低于系统性淋巴瘤[5-7]。 基于此,团队启动格菲妥单抗治疗方案,患者经过两周期治疗后,即获深度缓解,连续12周期治疗维持CR,神经功能明显恢复,影像学检查无复发迹象,生存状态优良,治疗效果令人印象深刻(图1)。卢绪章教授强调:“这一突破不仅为R/R PCNSL患者带来了新的治疗方向,也验证了格菲妥单抗在穿越血脑屏障后实现有效免疫治疗的可行性,实现了临床领域的急需突破。”
揭秘格菲妥单抗穿透血脑屏障的关键机制,为中枢免疫治疗奠定基础 除了临床数据,研究团队深入探索格菲妥单抗作用机制,从患者治疗期间采集脑脊液(CSF)样本进行体外共培养实验。结果显示,患者CSF中药物浓度虽低,但足以促进T细胞活化,表现为CD25和CD69的显著表达上调。更重要的是,加入CSF和格菲妥单抗的体外培养体系中,T细胞针对CD20+淋巴瘤细胞(OCI-Ly3)展现出明显的杀伤活性和显著凋亡,支持该药能够在中枢免疫抑制环境下有效重新激活细胞免疫功能。 卢绪章教授指出:“格菲妥单抗强效靶向CD20阳性肿瘤细胞,并通过其双靶点2:1分子结构结构,成功活化和招募CD3阳性T细胞,实现精准肿瘤杀伤。这些实验数据首次从基础角度证实了格菲妥单抗通过血脑屏障后,仍保留其免疫激活功能,不仅科学填补了该领域长期未解之谜,也为格菲妥单抗及类似双特异性抗体的发展应用奠定了坚实的基础。此外,该患者较好的基础免疫功能也是临床获益的重要保障。” 该机制研究丰富了我们对中枢淋巴瘤免疫治疗的认识,即便面对血脑屏障和免疫抑制微环境,创新免疫药物依然能够激活局部及系统免疫反应,从而实现肿瘤杀伤。 格菲妥单抗安全性优异,细胞因子综合征(CRS)管理是关键 安全性是免疫治疗应用的关键环节。在该患者的治疗过程中,患者经历1级CRS,表现为短暂发热、血压升高,均可控且无需停药。未观察到免疫效应相关神经毒性综合征(ICANS)或其他严重不良事件。卢绪章教授评价:“如此温和的安全性反映了格菲妥单抗在中枢肿瘤治疗领域的显著优势。相比CAR-T细胞疗法本身带来的严重神经毒性风险,双特异性抗体的免疫调控更为平衡和安全。” 但需要关注的是,鉴于中枢淋巴瘤高肿瘤负荷,临床应用中仍须严密监测神经症状的变化,及时干预预防ICANS等,可通过严密的神经监护实现安全用药。此外,B细胞消除导致的免疫球蛋白下降及迟发性血液学毒性,如中性粒细胞减少,也需系统管理。 双特异性抗体治疗策略多元,联合应用和早期干预前景广阔 双特异性抗体格菲妥单抗作为目前2线及以上R/R DLBCL标准之一,有望在中枢淋巴瘤治疗中提早应用,进一步改善患者预后。卢绪章教授建议:
|